近期,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室、药物高通量筛选技术国家地方联合工程研究中心魏子贡教授团队在人工智能药物设计方面取得系列进展。
随着计算能力和算法的不断进步,人工智能已在药物设计展现出巨大的潜力。传统药物设计方法通常依赖高通量筛选,存在周期长(10-15年)、成本高(平均26亿美元/药物)等特点,而利用人工智能通过深度学习、强化学习等模型,在实现快速筛选的同时,还可以生成多目标的全新分子并预测其靶点-配体结合模式,从而缩短研发周期、降低成本。该团队通过循环神经网络以及强化学习等发现了人畜共患病病原微生物伪狂犬病毒,猴痘病毒等的高活性先导化合物,筛选得到的化合物c14抗PRV活性达到14 pM,A68对猴痘病毒主蛋白酶抑制活性达到9 μM,为小分子兽药研发奠定了基础。
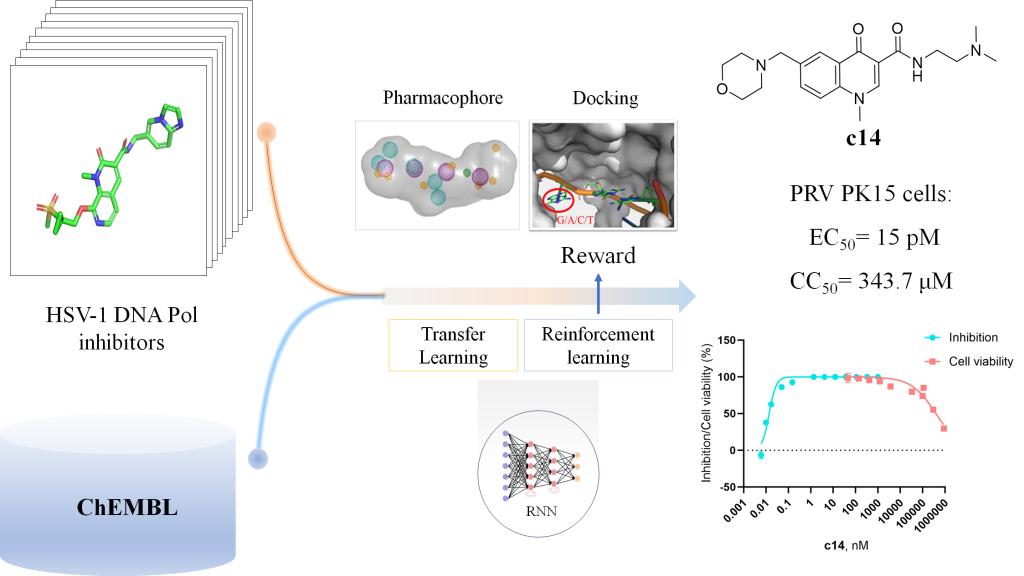
图1 利用循环神经网络与强化学习生成伪狂犬DNA聚合酶抑制分子过程示意图
Wei L, Hu Y, Bai L, Xiao C, Liu Z, You Y, Wang K, Huang Y, Zhu J, Weng J, Zhou W, Li H, Zhao H, Wu Z, Mei M, Wei Z. Design of the Inhibitors for Pseudorabies Virus Replication by Reinforcement Learning from HSV-1 DNA Polymerase Inhibitors. ACS Omega. 2025 Jan 23;10(4):3389-3397. doi: 10.1021/acsomega.4c06508.
Wei L, Wu Y, Li S, Weng J, Geng M, Mei M, Wei Z. In vitro enzyme characterization and several inhibitors for monkeypox virus core protease I7L. FEMS Microbiol Lett. 2025 Jan 10;372:fnaf008. doi: 10.1093/femsle/fnaf008.
迷你粘体(mini-binder)是介于抗体和小分子药物之间的一种全新药物类型,兼具抗体和小分子的优点而成为近年来新药研发的热点。团队前期通过基于ProteinMPNN等人工智能模型成功设计靶向IL-2、TNFR1受体等靶点的mini-binder(Int. J. Biol. Macromol., 2024, 276,133834;Int. J. Biol. Macromol., 2025, 293,139403)。近日,团队再次在《International journal of biological macromolecules》杂志发表题为“Mini-binders targeting Streptococcus equi ssp. zooepidemicus M-like protein inhibit the bacterial adhesion and exert protective effects in vivo”的研究论文,报道了利用RFdiffusion从头设计的mini-binder,能够以高亲和力结合SzM的纤维蛋白原黏附区,显著抑制SEZ对宿主细胞的黏附,并对SEZ感染小鼠模型提供高效的保护作用。
(Ming K, Liu Z, Chen X, Chen M, Yang Y, Gan T, Wang L, Wang K, Xing B, Weng J, Wei L, Wang Z, Wei Z. Mini-binders targeting Streptococcus equi ssp. zooepidemicus M-like protein inhibit the bacterial adhesion and exert protective effects in vivo. Int J Biol Macromol. 2025 304: 140803)
马链球菌兽疫亚种(Streptococcus equi subsp. zooepidemicus, SEZ)是猪链球菌病的一种重要病原,引起猪的肺炎、败血症、关节炎,甚至突然死亡,造成巨大的经济损失。SzM是SEZ表面的一种重要的黏附因子,通过粘附纤维蛋白原介导细菌对宿主细胞的黏附。
去噪扩散概率模型(DDPM)是一类强大的机器学习模型,可以通过文字提示来生成逼真的图像。DDPM具有高度多样化的输出,可以对蛋白质三维结构进行建模。同时,在迭代生成过程的每个步骤中可以对DDPM进行指导以实现特定的设计目标。但是去噪网络生成真实蛋白质骨架的能力有限,可以利用结构预测方法AF2或RosettaFold中包含的对蛋白质结构的理解,来开发蛋白质设计的扩散模型。RFdiffusion是基于RosettaFold的扩散模型,利用该模型可以实现针对任意蛋白质靶点设计具有高亲和力的氨基酸数量不等的结合蛋白。
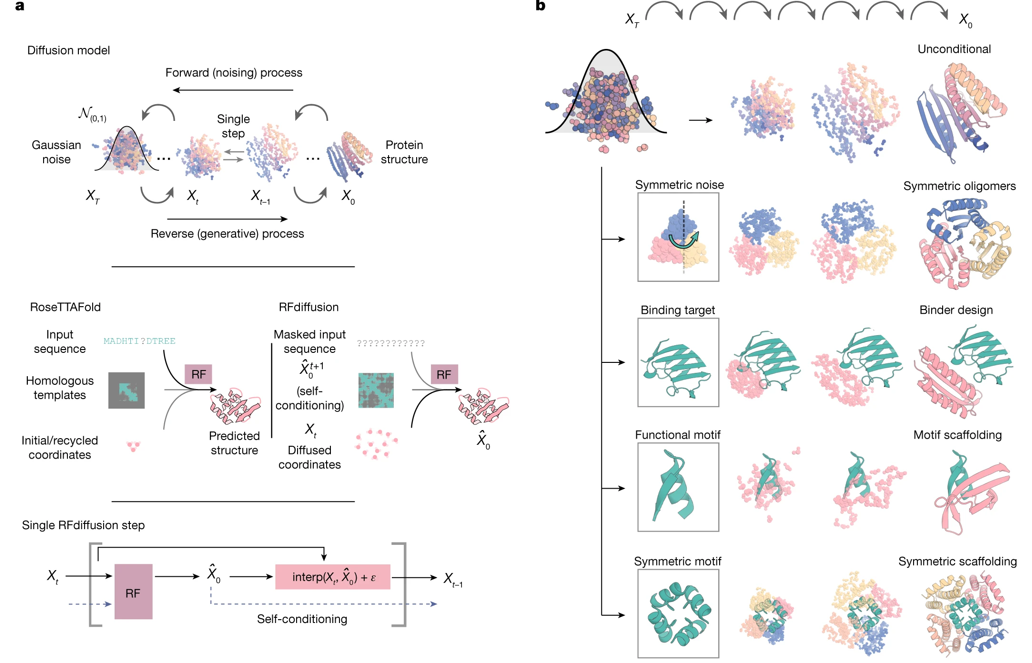
图2 利用扩散模型(RFdiffusion)从头设计蛋白质的原理及流程示意图
研究团队以SzM的N端可变区的纤维蛋白黏附区为靶点,通过疏水性分析确定结合界面,利用RFdiffusion设计了一系列候选mini-binder。经过pTM、ipTM、自由能、packstats等多项指标的严格筛选,最终确定并合成了4个mini-binder进行实验验证。通过生物层干涉技术(BLI)筛选,获得2个与靶蛋白具有微摩尔级亲和力的binder(binder 3和binder 4)。圆二色谱分析显示,这两个binder在95℃高温下仍能保持结构稳定,表现出优异的热稳定性。体外实验证实,这两个蛋白能显著抑制SEZ对纤维蛋白原和HEp-2细胞的黏附。动物实验进一步证明,binder 3将SEZ感染小鼠模型的存活率提升至80%,展现出显著的抗菌效果。
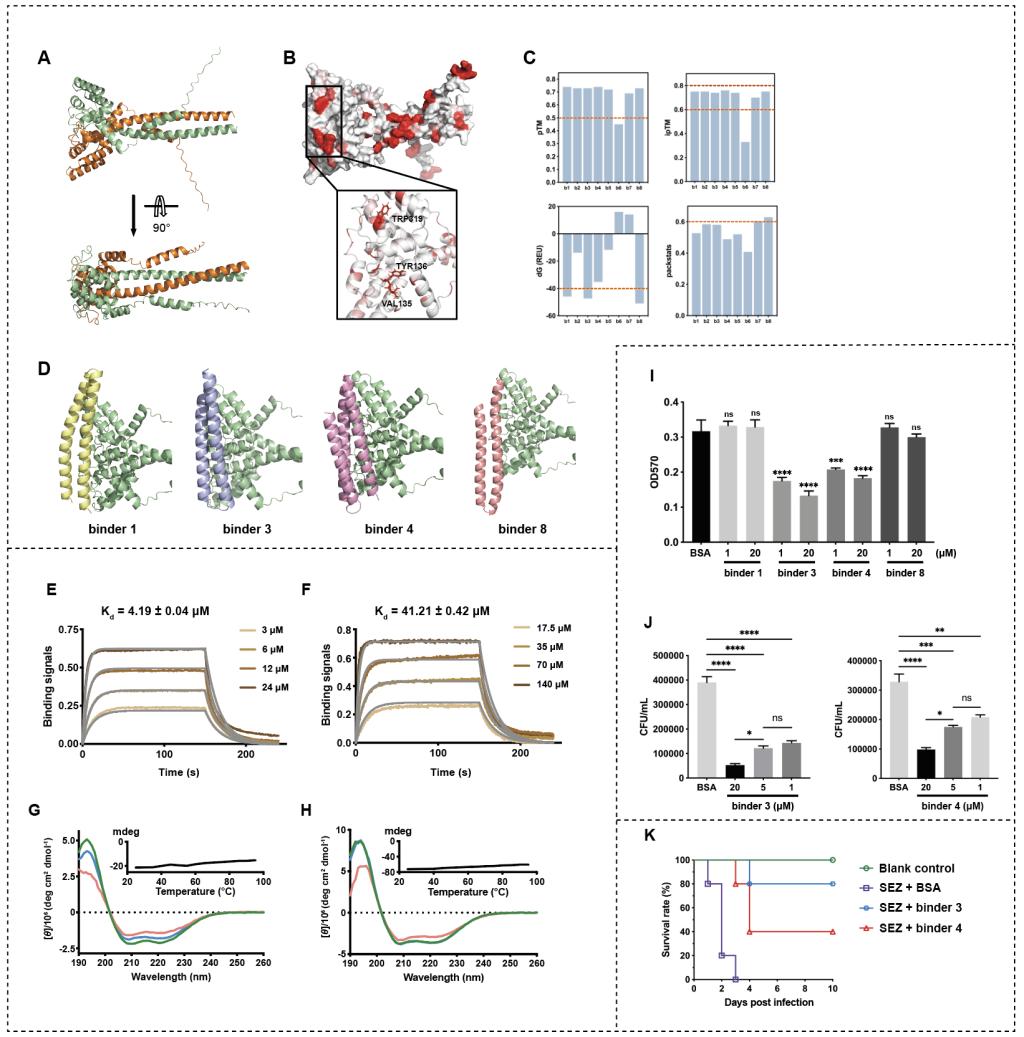
图3 靶向SzM的mini-binder设计及评价
湖北大学生命科学学院魏子贡教授为本文通讯作者,青年教师明珂、研究生刘张、陈秀娟、陈美廷为共同第一作者。该研究成果不仅为SEZ感染的防治提供了新的解决方案,也为人工智能在药物设计领域的应用开辟了新的方向。
魏子贡教授团队长期从事人工智能药物设计。团队围绕严重危害规模化健康养殖过程中的感染相关病原微生物,基于特定靶点,利用深度学习、强化学习等手段进行大分子药物如疫苗、纳米抗体、mini-binder,以及小分子药物如中药单体、化学小分子药物的高通量筛选与计算设计,目前已取得系列创新性研究进展。
团队长期招收具有药学、计算机、生化与分子生物学、微生物学等学科背景的研究生,欢迎各位同学报考。
论文链接:
https://doi.org/10.1021/acsomega.4c06508
https://doi.org/10.1093/femsle/fnaf008
https://doi.org/10.1016/j.ijbiomac.2025.140803




