近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室马立新教授团队在肿瘤联合治疗领域取得新进展。相关成果“Somatostatin receptor-targeted polymeric nanoplatform for efficient CRISPR/Cas9 gene editing to enhance synergistic hepatocellular carcinoma therapy”(靶向生长抑素受体的聚合物纳米平台递送CRISPR/Cas9基因编辑系统用于肝癌基因治疗的研究)发表在《Journal of Nanobiotechnology》上(中科院一区,IF=10.6)(图1)。湖北大学生命科学学院硕士生张素琴为论文第一作者,罗静雯副教授、王飞副教授和王洋副教授共为该论文通讯作者,湖北大学为第一单位。

图1.文章首页
科研团队成功研发了一种创新的纳米药物递送系统,通过合成新型高分子材料LNA-PEG-OCT和PEI-OA构建多功能纳米粒,可同时递送化疗药物紫杉醇(PTX)和基因编辑工具CRISPR/Cas9核糖核蛋白复合物(RNP),实现化疗与基因治疗的协同作用。该研究成果为肝癌的联合治疗提供了新策略,展现出显著的抗肿瘤效果和良好的安全性。
该纳米递送系统具有以下优势:一是粒径小、稳定性高,在体外和体内均表现出优异的稳定性,确保药物高效递送。二是高效杀伤肝癌细胞,对HepG2肝癌细胞具有高度细胞毒性,同时具备肝脏靶向性,减少对正常组织的损伤。三是基因编辑与化疗双管齐下,该纳米系统不仅能高效递送大分子基因编辑药物(如Cas9 RNP),还能同时包裹小分子化疗药物(如PTX)。PTX发挥化疗作用,直接杀伤肿瘤细胞,CRISPR/Cas9 RNP精准编辑PD-L1基因,降低PD-L1蛋白表达,阻断肿瘤免疫逃逸。四是激活免疫应答,实验显示,肿瘤微环境中CD8+和CD4+T细胞数量显著增加,表明PD-L1基因突变有效增强T细胞抗肿瘤活性(图2)。
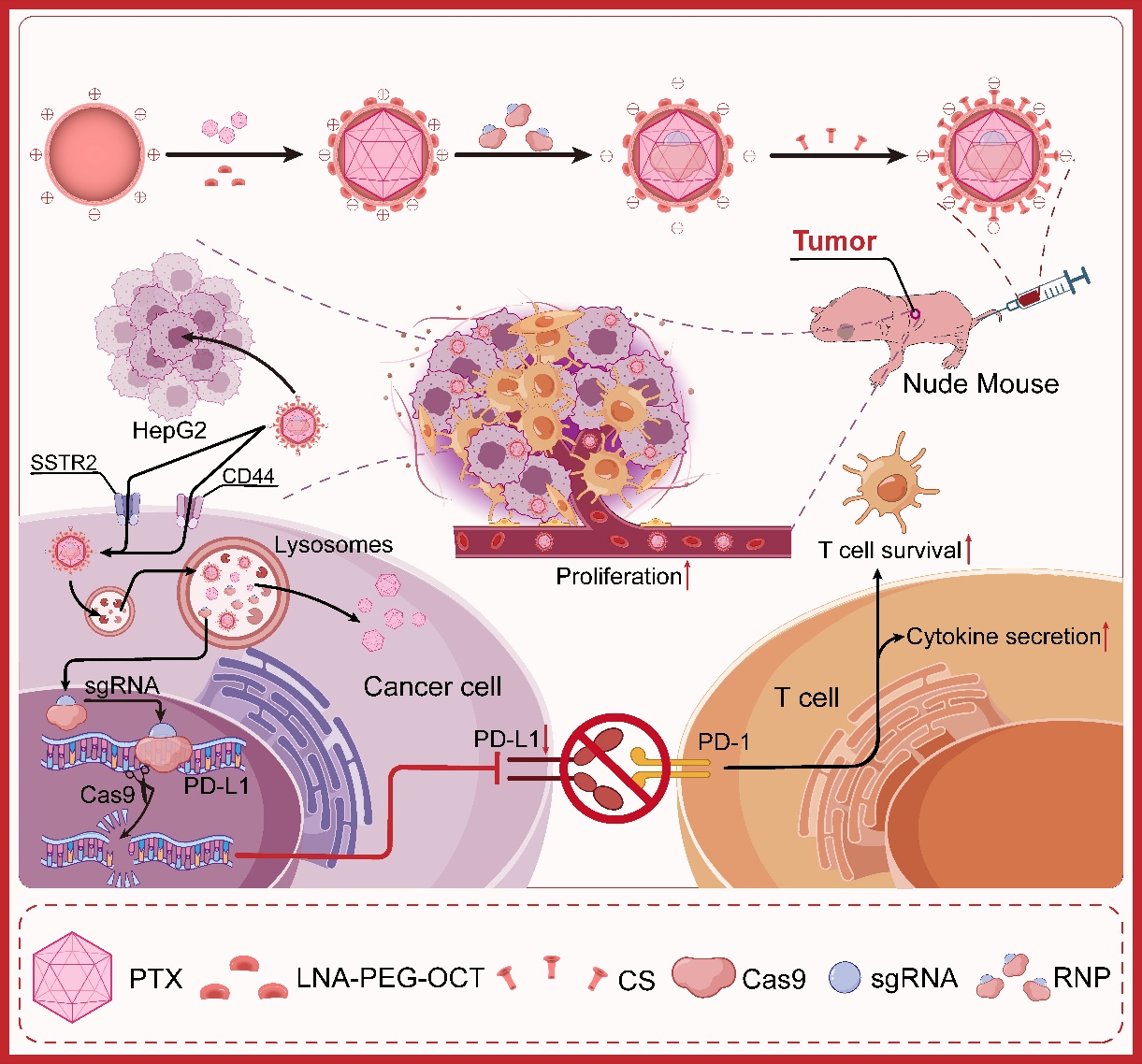
图2.基因编辑与化疗联合治疗肝癌的示意图
马立新教授团队长期致力于可编程核酸酶的发掘与应用研究,近年来在相关领域取得了系列创新成果,在《Molecular Cell》、《Nucleic Acids Research》、《Advanced Science》、《Biosensors and Bioelectronics》等国际顶尖期刊发表多篇高水平论文,获授权国内外发明专利10余项。未来,团队将继续深化新型基因编辑系统研究,并推动其在基因治疗、合成生物学等领域的产业化应用,为我国抢占基因编辑技术制高点提供核心工具支撑。
论文链接:https://doi.org/10.1186/s12951-025-03214-3
(审核人:李爱涛)




